Para confirmar se a pessoa está com COVID-19 ou não, até o momento, existem os testes que usam sangue, soro ou plasma e os outros que precisam de amostras de secreções coletadas das vias respiratórias, como nasofaringe (nariz) e orofaringe (garganta).
E o que são os testes rápidos?
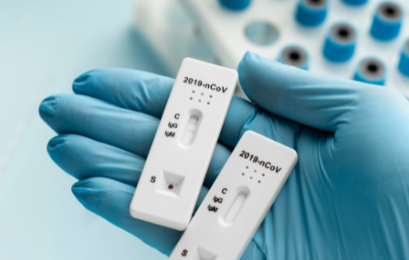
Esse termo vem sendo usado popularmente para os testes imunocromatográficos. Eles conseguem dar o resultado entre 10 e 30 minutos.
São feitos a partir de amostras de sangue, soro ou plasma e usam uma metodologia chamada imunocromatografia.
Nesse método, a reação entre o antígeno e o anticorpo gera uma alteração de cor. Ela indica a detecção dos anticorpos produzidos pelo próprio organismo do paciente em resposta à infecção pelo novo coronavírus, chamados de IgM e IgG.
Esses indicadores revelam se a pessoa teve ou não contato com o vírus.
Tendo em vista que o organismo demanda um tempo para a produção desses anticorpos (janela imunológica), esse exame é indicado a partir de 10 dias após o início dos sintomas.
No momento, farmácias NÃO podem aplicar esse teste. Somente os laboratórios clínicos, serviços ambulatoriais e hospitalares estão autorizados.
Conheça os outros testes:
Também foram aprovados testes para detecção de anticorpos com o uso de outras metodologias, como:
- ELISA: se baseia numa reação enzimática;
- CLIA (imunoensaio quimioluminescente): torna a reação antígeno-anticorpo visível por uma reação química;
- Imunofluorescência: no qual a leitura do resultado é feita a partir da fluorescência formada na reação do antígeno com o anticorpo.
Além disso, também há o RT-PCR (sigla em inglês para transcrição reversa seguida de reação em cadeia da polimerase).
Esse tipo de teste se baseia na detecção de fragmentos do material genético do vírus e revela se a pessoa está doente no momento da realização do exame, porém não detecta contágios passados.
Todos os testes precisam ser registrados na Anvisa. Nesta fase, é exigida a apresentação de documentos da empresa, como Autorização de Funcionamento de Empresa (AFE) e Certificação de Boas Práticas de Fabricação (CBPF).
Também devem ser apresentados documentos sobre o produto a ser registrado, tais como ensaios clínicos, fluxo de produção, estudo de estabilidade e outros dados que indiquem a sua segurança, qualidade e eficácia. O objetivo é avaliar se o produto é capaz de dar o resultado para o qual foi desenvolvido.
Segundo a Sociedade Brasileira de Análises Clínicas (SBAC), entre os dias 18 de março e 16 de abril, a Anvisa recebeu 157 solicitações, das quais 39 foram aprovadas.
Outras 51 petições já foram analisadas e se encontram em fase de exigência. Cinco pedidos foram negados e os demais estão em avaliação ou aguardando o início da análise.
Saiba quais são os produtos para diagnóstico in vitro de Covid-19 regularizados aqui.
Para continuar recebendo conteúdos sobre a área de Infectologia, siga as minhas redes sociais: Facebook, Instagram, Linkedin e entre na minha lista para médicos e profissionais da saúde no Telegram.
Fontes: Sociedade Brasileira de Análises Clínicas (SBAC) e Agência Nacional De Vigilância Sanitária (ANVISA).